含有顺铂前药用于免疫-化疗联合疗法的多功能抗癌复合物
癌症免疫疗法是近年来肿瘤治疗的一个新的发展方向,也是当前癌症研究领域中的热点之一。它是通过调动患者自身的免疫细胞来抵御、杀死肿瘤细胞。免疫检查点抑制剂(check-point inhibitor)疗法是目前世界上肿瘤免疫治疗的主要研究方向之一,针对CTLA-4、PD-1/PDL-1等免疫检查点的抑制剂已经得到FDA的批准上市。除此之外,吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)作为人体色氨酸代谢的关键限速酶可以抑制T细胞功能的发挥,导致T细胞的凋亡以及肿瘤细胞逃逸,因而成为肿瘤免疫疗法的一个热门靶点。此外,IDO抑制剂能够加强化疗药物的作用,进一步提高抗肿瘤作用。目前已有多个IDO抑制剂进入临床阶段,而IDO抑制剂与化疗药物的联用在目前的研究中少有涉及。
近日,香港城市大学的朱光宇教授(点击查看介绍)课题组针对这一问题设计了一种包含免疫检查点抑制剂和顺铂抗癌前药的多功能纳米复合物体系,通过免疫-化疗的联合疗法,针对卵巢癌进行有效治疗。他们的设想是当纳米复合物通过胞吞作用进入卵巢癌细胞后,能够同时释放IDO抑制剂(IDOi,IDO inhibitor)和顺铂前药。释放出的IDO抑制剂能够阻断癌细胞中色氨酸的代谢,从而刺激T细胞的增殖和识别癌细胞,最终促进癌细胞的凋亡;另一方面,与IDO抑制剂同时释放的顺铂前药也能够有效杀死癌细胞(图1)。

图1. 载有顺铂前药及IDO抑制剂的纳米复合物进行免疫-化疗联合治疗的机理。图片来源:Angew. Chem. Int. Ed.
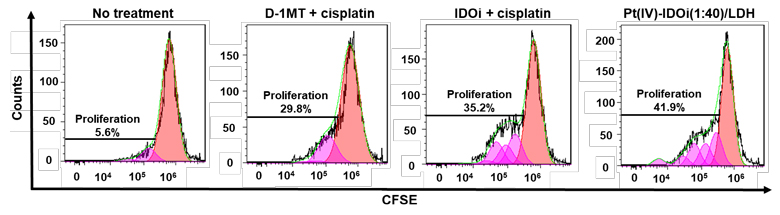
图2. 体外HeLa细胞和免疫细胞共培养体系中不同复合物处理后T细胞的增殖情况。图片来源:Angew. Chem. Int. Ed.
作者首先对含有不同比例的顺铂前药和IDO抑制剂的纳米复合物进行了表征。经过筛选,他们发现Pt(IV)-IDOi(1:40)/LDH在HeLa细胞中的活性最为突出,细胞毒性的IC50是0.3 µM,远低于顺铂前药和IDO抑制剂本身,并且可以有效抑制细胞中IDO酶的活性,因此对该比例的纳米复合物做进一步的研究。在细胞实验中,该纳米复合物能有效提高铂在细胞内的摄取量,同时增加结合到DNA上铂的含量,从而导致经过纳米复合物处理的卵巢癌细胞与单纯使用顺铂处理的细胞相比细胞凋亡显著增加。有趣的是,纳米复合物中免疫检查点抑制剂不但能有效抑制IDO,也可扭转免疫抑制的T细胞识别癌细胞,从而促使T细胞的增殖和活化(图2),造成肿瘤细胞周期阻滞(图3),并最终促进癌细胞凋亡。在小鼠活体实验中,该纳米复合物同样也展现出对卵巢癌肿瘤有效的抑制能力(图4)。综上所述,该研究设计合成了一种用于免疫-化疗联合疗法的多功能抗癌复合物,为提高铂类药物对卵巢癌的治疗效果提供了一种新的治疗策略。

图3. 不同条件下HeLa细胞的细胞周期阻滞。图片来源:Angew. Chem. Int. Ed.
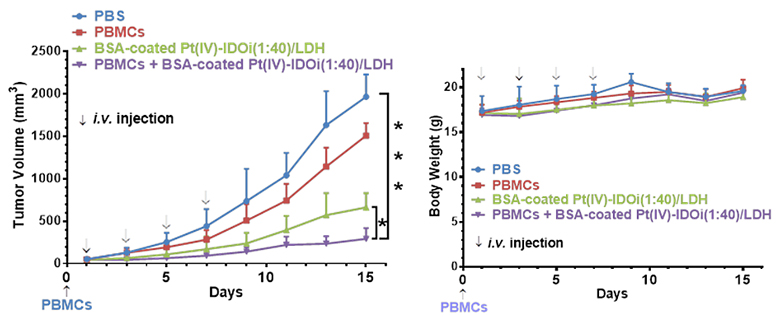
图4. 纳米复合物在小鼠体内的抗肿瘤活性及体重变化。图片来源:Angew. Chem. Int. Ed.
这一成果近期发表在Angewandte Chemie International Edition 上,文章的第一作者是香港城市大学的博士研究生王娜。
该论文作者为:Na Wang, Zhigang Wang, Zoufeng Xu, Xianfeng Chen and Guangyu Zhu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Cisplatin-Loaded Immunochemotherapeutic Nanohybrid Bearing Immune Checkpoint Inhibitors for Enhanced Cervical Cancer Therapy
Angew. Chem. Int. Ed., 2018, 57, 3426, DOI: 10.1002/anie.201800422
导师介绍
朱光宇
http://www.x-mol.com/university/faculty/26823
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号