肿瘤微环境三重响应乳清蛋白纳米载体实现乳腺癌的高效治疗
能够根据肿瘤微环境响应兼具抗肿瘤和抗转移效果的智能载体是极具前景的肿瘤治疗策略。中国农业大学北京市食品营养与人类健康高精尖创新中心的分子营养实验室研发了一种能够根据肿瘤微环境智能响应的蛋白质纳米载药系统,表现出高效的抗肿瘤和抗转移效果。该成果被国际著名纳米综合期刊Nanoscale 选为封面热点文章(图1)。

图1. 封面
该纳米载体取材绿色、设计巧妙,可在肿瘤部位依次针对肿瘤表面过表达酶、微酸和高谷胱甘肽(GSH)浓度等微环境实现三重响应性释药(图2)。作者首先通过定向酶解奶酪副产物-乳清蛋白获得两亲性多肽,在水溶液中可自组装形成30纳米单分散胶束peptosome (PS),高效荷载疏水性抗癌药物姜黄素Cur,解决了姜黄素水溶液难溶的问题,并降低其对正常组织的副作用。随后他们对其表面修饰功能肽段PePm,其中Pe可靶向乳腺癌表面的ErB2受体,且兼具较好的抗癌转移效果。此外,Pm片段可以根据肿瘤表面过表达金属基质蛋白酶MMP的特异性水解,通过交联单个载体内部自身巯基形成二硫键,使PS具有癌细胞高GSH浓度响应释药的功能。他们将所构建的载体PePm/PS/Cur经尾静脉注射到小鼠体内后,经EPR效应和Pe的靶向效应在肿瘤部位高度富集,载体表面Pe肽被MMP水解脱离,使Pe肽留在肿瘤细胞表面发挥抑瘤和抗转移效果。PS/Cur继续通过“质子海绵”效应从癌细胞溶酶体中逃逸,在细胞质内通过GSH响应逐渐解体,释放出PS/Cur内荷载的姜黄素,发挥抑制肿瘤的作用。
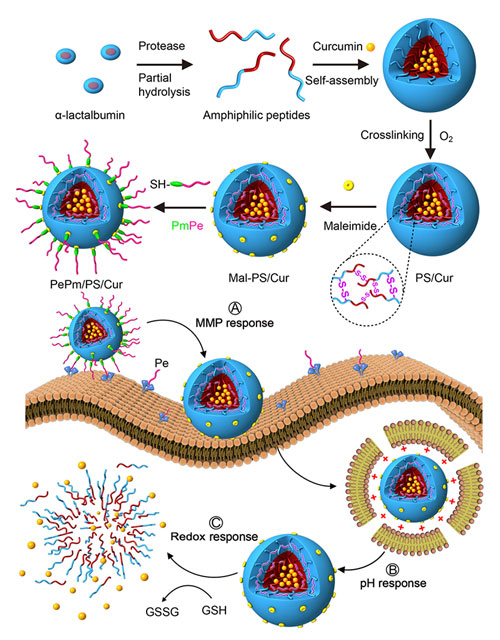
图2. PS载体的设计、合成及肿瘤环境三重响应释放的示意图
从纳米颗粒表征的实验结果来看,PS直径约为30 nm球形,具有良好的分散性和血清稳定性(图3)。
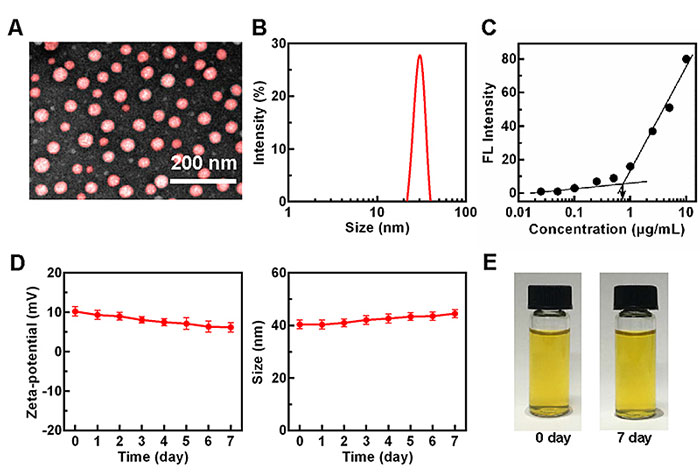
图3. PePm/PS物理化学性质的表征
该载体在动物水平表现出优异的靶向性和抗癌效果(图4)。作者利用鼠源乳腺癌细胞系4T1肿瘤移植小鼠模型进行研究,小动物活体荧光成像结果显示,PePm/PS相对于PS表现出更强的靶向性,并在肿瘤中高效富集。由于姜黄素具有难溶于水和脱靶副作用大等缺点,极大限制了其在肿瘤治疗中的应用。但是,经过PePm/PS荷载后,其抗肿瘤效果明显增强,对正常组织的副作用降低,同时有效抑制了癌细胞在肺部和骨关节的转移,极大地提高了食源性纯天然化合物姜黄素抑制肿瘤的效果。该成果对于肿瘤的有效治疗具有重要的意义。
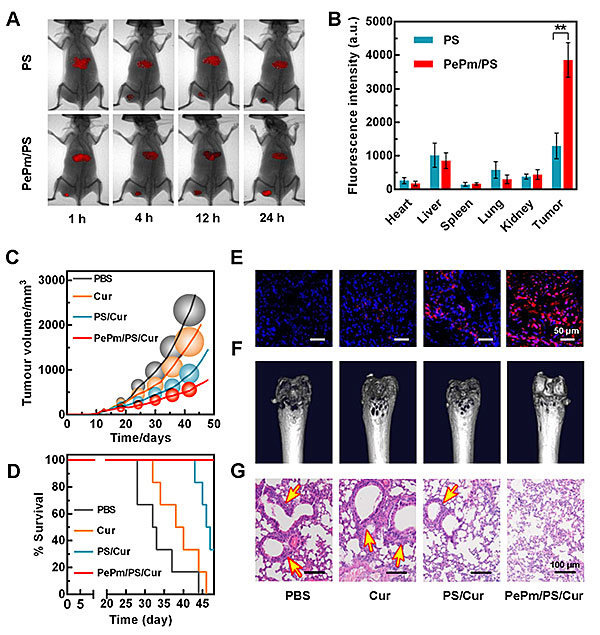
图4. PePm/PS/Cur的抗肿瘤及抗肺、骨转移效果
该研究工作受到了国家自然科学基金委(31471577)、北京市科委科技新星计划(Z141102001814066)以及北京市高精尖创新中心的资助。
该论文作者为:Yuan Li, Wei Li, Weier Bao, Bin Liu, Dan Li, Yumeng Jiang, Wei Wei, Fazheng Ren
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bioinspired Peptosomes with Programmed Stimuli-responses for Sequential Drug Release and High-performance Anticancer Therapy
Nanoscale, 2017, DOI: 10.1039/C7NR00598A
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号