基因编辑“携手”化学合成:Nature报道生物体内手性有机硼化合物的合成
自然界由各式各样的生物体组成,形形色色的天然产物则是自然界的杰作。连接生物与化学两端的桥梁是生物大分子——酶,它由生物体的遗传物质DNA编码,参与催化几乎所有天然产物的生物合成。然而,并不是所有生物体系都可以像合成化学家那样随心所欲的合成各类化合物。在基因编辑手段的辅助下,酶的工程化拓展了生物催化的潜力,工程酶在试管中催化全新化学反应屡屡见诸报道。但是,要让新的化学反应在生物体内发生,依然困难重重。这不仅仅需要发展酶的新功能,还需要生物体能够接受非天然底物的补给,并将其转送至酶所在位置发生反应。
美国加州理工学院的化学家Frances Arnold教授(点击查看介绍),自上世纪90年代初提出“定向进化”的这一蛋白工程的重要策略以来,致力于开发酶的新功能。近期的代表性工作有:细胞色素P450用于烯烃的反马氏氧化(Science, 2017, 358, 215 点击阅读相关)和碳氢氨基化反应(Nat. Chem., 2017, 9, 627 点击阅读相关),以及细胞色素c用于构筑碳硅键(Science, 2016, 354, 1048 点击阅读相关)。最近,Arnold课题组又一力作发表于Nature,利用表达细胞色素c的大肠杆菌活体体系高效合成手性有机硼化合物。这一催化体系,具有高达15,300催化转化数(TTN),6100 h-1催化转化效率(TOF),以及99:1的手性选择性(e.r.)和100%的化学选择性。有意思的是,这种细胞色素c在体外的催化性能却远远不如体内反应,这也为生物体内的硼化学奠定了可能性。Jennifer Kan和Xiongyi Huang为该工作的共同第一作者。

Frances Arnold教授。图片来源:California Institute of Technology
有机硼化学不仅在合成化学上有着举足轻重的地位,在药物分子发展中也尤为重要。但迄今为止,自然界并未发现任何一种生物体可以合成有机硼化合物。基于Arnold课题组长期以来对血红素蛋白(具有铁卟啉中心结构的一类蛋白)的探索,作者认为,他们或许可以利用卡宾插入硼氢键的策略实现有机硼化合物在生物体内的合成。但仍然存在问题:1)即使在合成化学上,并未有先例报道含铁催化剂可以实现该转化;2)要实现体内合成,必须先考量相应底物的生物兼容性、胞膜穿透力以及在生物体内的稳定性、活性。庆幸的是,此前的研究显示不少硼试剂能够被生物活体内兼容,并有相应的化学生物学应用。于此,作者找到了一类合适的硼试剂——路易斯碱-硼烷复合物,并开始了这一项研究。
作者首先尝试了表达Rhodothermus marinus 细胞色素c(Rma cyt c)的大肠杆菌(E. coli)作为活体催化剂。以氮杂环卡宾-硼烷复合物(NHC-BH3)和2-重氮丙酸乙酯(Me-EDA)为初始底物,以表达野生型Rma cyt c(BORWT)的大肠杆菌为全细胞催化剂,能够催化合成目标有机硼化合物(120 TTN 和85:15 e.r.)。为提高该催化体系的催化效率,作者利用定向进化的手段对Rma cyt c 进行突变。在M100、V75和M103这三个靠近催化中心的位点依次进行了饱和突变,得到的三重突变体Rma cyt c V75R M100D M103T(BORR1)大幅提升了催化活性(2,490 TTN)和手性选择性(97.5:2.5 e.r.)(图1. a, b, c和d)。
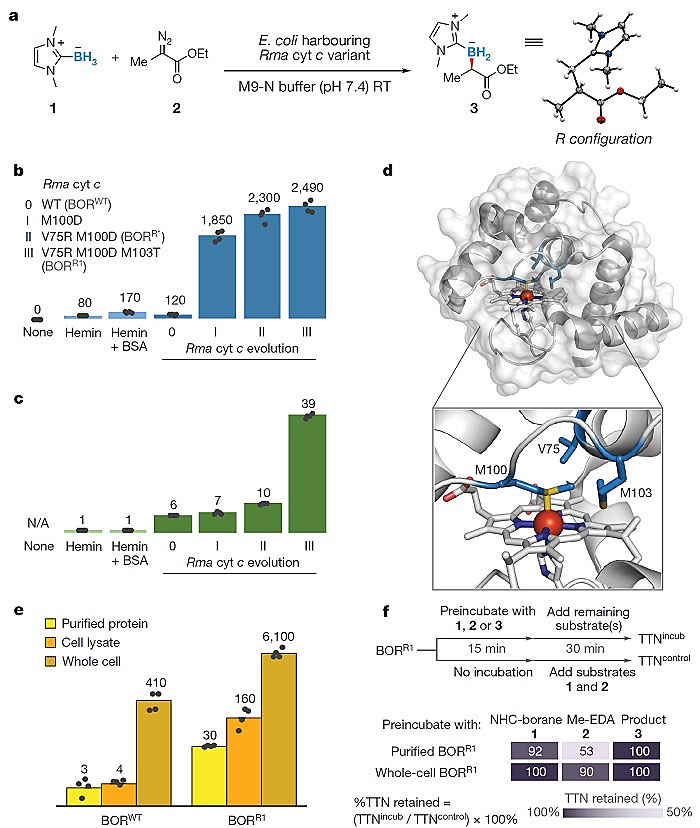
图1. a. 卡宾的硼氢插入反应;b, c. 定向进化(TTN 和 R/S 手性选择性);d. 蛋白结构及活性位点;e. 转化效率比较(TOF – log标度);f. 蛋白的失活研究。图片来源:Nature
为探讨不同突变体之间以及体内和体外反应的催化性能的差异,作者对反应在不同条件下作了动力学研究。在体内反应(以工程菌为全细胞催化剂)时,BORR1拥有6100 h-1 TOF,是BORWT的15倍之多。体外反应(纯化后的蛋白)时,相同的蛋白突变体,相比体内反应其转化效率大幅下降了两个数量级以上(图1. e)。为解释此差别,作者比较了底物与产物对蛋白本身的活性影响,发现在体外状态下蛋白更容易受卡宾前体Me-EDA的影响而失活;而在体内时,细胞环境对蛋白提供了很好的保护屏障而使之能有持续的活性(图1. f)。进一步的研究发现,在一轮体内反应结束后,不仅蛋白仍能保持稳定的活性使之依然可以进行下一轮的连续反应(图2. c),而且细胞本身也维持着良好的生命力。在反应结束后,当这些细胞重新被转移至凝胶培养基上,依然可以得到相当数量的菌落(与等细胞浓度的全新细胞相比)。
作者紧接着测试了该全细胞催化体系的底物范围。首先,吸电子、给电子以及多取代的NHC和甲基吡啶复合的硼烷,都能被该体系很好的接受,而且均给出了以千计的转化数以及非常好的手性选择性(图2. a)。然后,在卡宾前体上,不同的酯基,从小位阻的甲酯到异丙酯,甚至苄酯,均未对反应活性或选择性造成很大的影响。这说明在形成铁卡宾体的时候,酯基的朝向很可能是在溶剂暴露的区域(图2. d)。之后,该反应体系也被用到了克级的有机硼化合物的合成中,依然能维持2440的转化数和96:4的立体选择性(图2. b)。
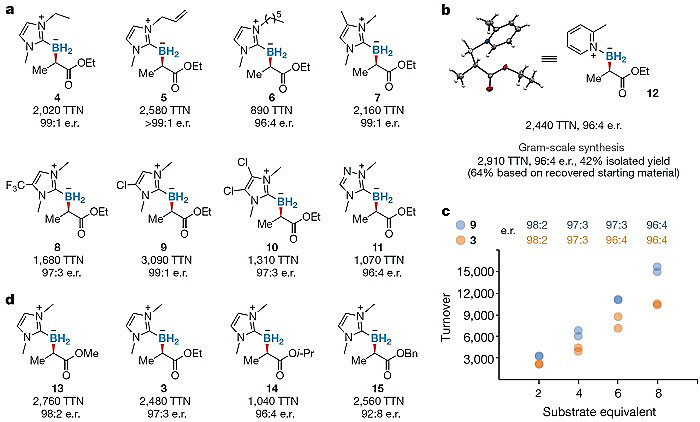
图2. a. 路易斯碱-硼烷的底物范围;b. 克级别的有机硼化合物合成;c. 有机硼化合物的连续生物合成;d. 卡宾前体的底物范围。图片来源:Nature
为进一步拓宽该生物催化体系的普适性,作者希望通过定向进化对蛋白结构做调整以接受结构差异更大的卡宾体(图3. a)。基于二重突变体BORR*,在M103位置的饱和突变,得到了BORR2和BORR3 两个突变体。前者能更高效的催化苄酯的卡宾前体与硼烷的反应(4200 TTN),后者能利用α-三氟甲基的惰性卡宾底物并以1560 TTN和95:5 e.r.得到相应的产物。与此同时,在V75位点引入一个脯氨酸(P)突变,可以造成蛋白内部三维结构的变化,这使得该催化体系能够接纳α-大位阻的卡宾体,比如Ph-EDA或者CF3-DMB。相继增加数个突变之后,BORP1以94:6的立体选择性催化了Ph-EDA与硼烷的反应;BORP2 则合成了R 构型的α-三氟苯乙基硼烷。除此之外,基于V75G的一个突变体BORG1很可能改变了卡宾体的朝向,使得在α-三氟苯乙基硼烷的合成中,得以翻转至S 构型。最后,作者对硼烷产物做了进一步转化,实现了α/β-三氟甲基手性醇的合成(图3. b)。
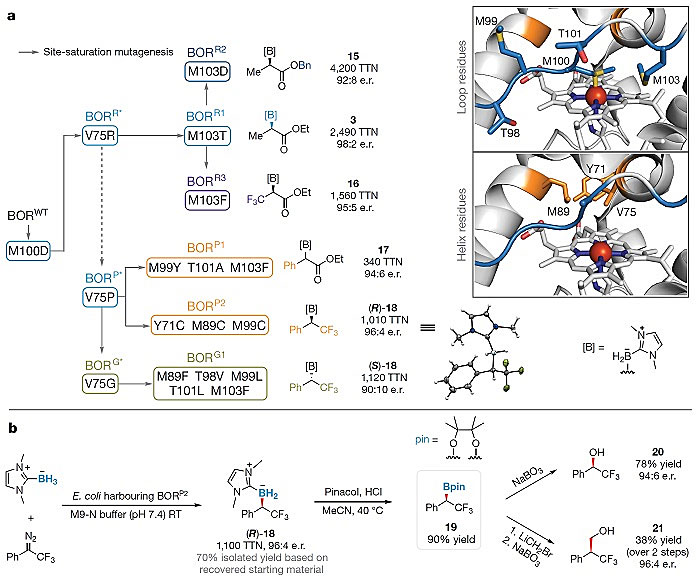
图3. a. 卡宾前体底物范围的进一步拓宽;b. α/β-三氟甲基手性醇的合成。图片来源:Nature
——总结——
Frances Arnold教授课题组展现了基因编辑在生物催化合成中的强大功能。通过操控DNA序列在相应的蛋白上引入突变,从而改写蛋白的催化活性,并实现了在生物体内高效、高选择性以及克级规模的有机硼化合物的合成。相比于传统有机催化中的复杂配体或过渡金属复合物的设计与制备,基于生物体的催化更易通过基因手段操控/更改,拥有更广泛的可调控性(20n突变种类)。生物催化以它自身的特质提供了一套切实可行且强有力的方案用于药物、农药、材料以及燃料等的合成。进一步与发酵工程相结合,或可实现更大规模、更廉价、更程序化的生产流程。至此,碳硼键构筑已然可纳入合成生物学之中。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Genetically programmed chiral organoborane synthesis
Nature, 2017, DOI: 10.1038/nature24996
导师介绍
Frances Arnold
http://www.x-mol.com/university/faculty/438
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号